| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | |||
| 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| 26 | 27 | 28 | 29 | 30 | 31 |
- 노션 단축키
- 퍼옥시좀
- 인슐린
- 전자전달 복합체
- 글라이옥시좀
- 노션 블록
- 선구동물
- 티스토리챌린지
- 캘빈회로
- 베타 산화
- 광호흡
- 노션 필수 단축키
- 콜레스테롤
- 인테그린
- 간극연접
- 오블완
- 당분해
- 단백질 분류
- 초나선
- 당지질
- 인지질
- 후구동물
- 역수송체
- 루비스코
- 신호서열
- 네른스트 방정식
- 밀착연접
- 차등 전위
- 광계
- 수동수송
- Today
- Total
숭늉의 연구일지
[생물 임용 노트] 물 - 2) 산과 염기: 산과 염기의 개념, pH, 적정곡선 본문
산과 염기의 개념
산(acid): 물에 녹아 양성자를 방출하고 H3O+를 형성하는 물질
→ 양성자를 얼마나 쉽게 내어주냐에 따라 강산과 약산으로 구분된다 예> HCl(강산), CH3COOH(약산)
염기(base): 양성자를 받아들일 수 있는 분자
→ 비슷한 의미로 양성자를 받아들이는 정도에 따라 강염기 약염기로 구분된다 예> NaOH(강염기), NH2(약염기)
** 강산과 강염기는 수용액에서 완전히 이온화된다.
약산과 약염기는 생체내에서 대사와 조절에 중요한 역할을 한다.
→ 짝산-염기 쌍을 구성한다. (HA ↔ H++ A-)
이때 강산의 짝염기는 약염기가 되고, 강염기의 짝산은 약산이 된다

산해리 상수
조금 더 깊게 산과 염기를 이해하기 위해서는 평형 상수의 개념을 이해할 필요가 있다.
평형 상수는 간단히 말하면 화학반응에서 반응물과 생성물의 비(생성물/반응물)를 나타내는 것이다. 화학반응은 양방향으로 일어나므로 이는 정반응과 역반응의 비율이라고도 볼 수 있다.
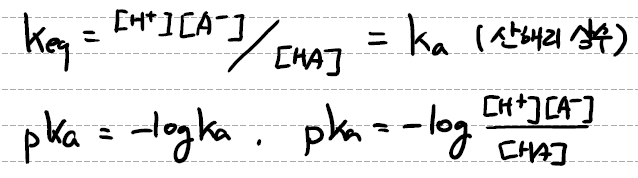
평형상수 keq의 정의를 산의 화학반응에 대입하면 keq = [H+][A-]/[HA]이다.
이는 산(HA)이 해리되어 H+를 방출하는 정도를 나타내고 이를 산해리 상수(ka)라고 한다.
산해리 상수에 -log를 씌운 값을 pka라고 하며, pka = -log([H+][A-]/[HA])가 된다.
이를 통해 2가지 경향을 도출할 수 있는데,
1) pka가 작을수록 평형은 정반응에 기울어져 있다. - ka는 강산에서 크고, 약산에서 작다
2) pka가 작으면 반응물은 강한 산이 되고 반응 후에 약한 염기가 된다.
짝염기도 같은 식으로 구하여 pkb(염기 해리 상수)를 구할 수 있고, pka + pkb = 14이다.
물의 평형 상수와 pH
물분자는 가역적으로 이온화하여 H+와 OH-를 생성한다. 그리고 여기서 생성된 H+는 H2O와 결합하여 H3O+(하이드로늄 이온)를 만들어낸다.
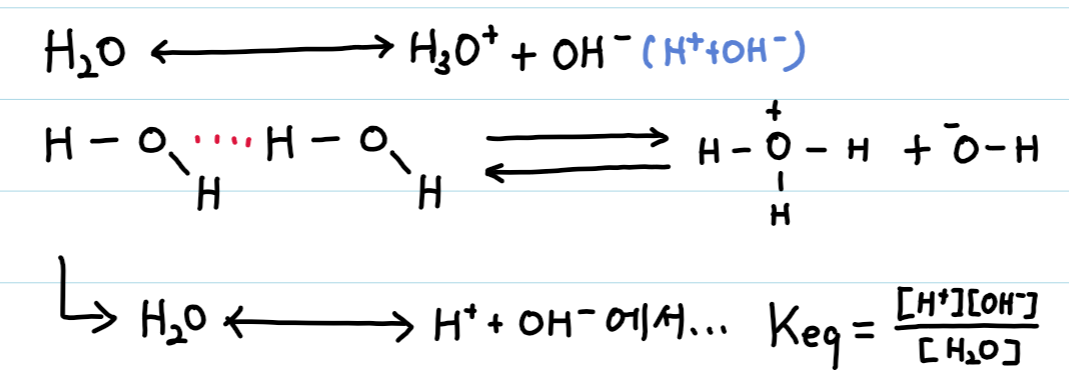
25℃ 순수한 물 1L의 몰수는 55.5M이며, 실험적으로 측정한 전기 전도도를 바탕으로 계산한 keq의 값은 1.8 × 10-16이다. 이를 바탕으로 kw(물에서 산과 염기의 이온농도의 곱)를 구하면,
keq = [H+][OH-]/[H2O]
(55.5M)keq = [H+][OH-] = kw
1.0 × 10-14 = kw
중성상태에서 [H+]=[OH-] 이므로 [H+]=[OH-] = 10-7
이때, pH = -log[H+]로 정의한다.
따라서 중성상태의 pH = 7이라고 정의한다.
**체액의 농도는 거의 중성상태이며 pH 7.4 이상이면 알칼리 혈증, pH7.4 이하로 떨어지면 산 혈증이라고 한다.
적정곡선
적정(titration): 어느 용액의 물질의 양을 정량하기 위해 사용하는 방법
→ 산을 적정하기 위해서는 첨가된 NaOH의 양에 따른 산의 농도를 계산하면 된다.

NaOH 첨가시 유리된 H+는 제거되고 HAc는 자신의 해리 상수를 만족하기 위해 더 해리하게 된다.
0.5 당량에서 [HAc] = [Ac-]인 상태가 되고 이때의 pH를 pka라고 한다(또는 이때의 pH는 pka와 같게 된다.).
'생물학 임용노트 > 물' 카테고리의 다른 글
| [생물 임용 노트] 물 - 2) 산과 염기: 완충계, Handerson-Haselbach식 (0) | 2021.11.30 |
|---|---|
| [생물 임용 노트] 물 - 1) 물: 물의 구조와 성질, 확산과 삼투, 수분 퍼텐셜 (0) | 2021.11.25 |


