| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
- 오블완
- 단백질 분류
- 역수송체
- 네른스트 방정식
- 인테그린
- 노션 필수 단축키
- 신호서열
- 노션 단축키
- 선구동물
- 광호흡
- 후구동물
- 광계
- 퍼옥시좀
- 인슐린
- 초나선
- 전주 결혼
- 콜레스테롤
- 캘빈회로
- 밀착연접
- 티스토리챌린지
- 노션 블록
- 차등 전위
- 인지질
- 간극연접
- 글라이옥시좀
- 루비스코
- 베타 산화
- 수동수송
- 전주 결혼 준비
- 당지질
- Today
- Total
숭늉의 연구일지
[생물 임용 노트] 단백질 - 3) 단백질의 기능: 단백질의 기능, 리간드의 상호작용 본문
1. 단백질의 기능
단백질은 세포의 거의 모든 기능을 수행한다.
→ 효소, 구조, 수송, 운동, 저장, 신호, 수용체, 유전자 등에 관여한다.
1) 역동적인 분자로 기능이 항상 다른 분자와의 상호작용에 의존한다.
2) 다른 분자와의 가역적 결합을 수반한다. → ligand 결합이 종종 단백질의 입체 형태 변화를 야기한다.
2. 단백질과 리간의 상호작용
1) 단백질-리간드 상호작용의 정량적 표현

단백질에 대한 리간드의 친화도를 ka로 표현이 가능하다. → 평형 상수로 표현

ka는 결합 상수로 클수록 리간드의 단백질에 대한 친화력이 더 크다. 단백질의 리간드 결합부위 중 50%가 채워질 수 있는 리간드의 농도는 1/ka이라고 한다.(kd(해리상수) = 1/ka로 표현 가능하고, 작을수록 친화력이 크다.)

[L] >>> [P] 에서 [L]의 [P]의 결합은 [L]을 크게 변화시키지 못한다. 이때 결합 평형수 θ를 리간드가 차지하는 단백질의 리간드 결합자리의 비라고 하면,

이를 kd와 [L]의 관계를 그래프로 나타내면,

3. 리간드의 상호작용 예 - heme(헴)
단백질을 구성하는 아미노산의 R기 중 어느 것도 O2 가역적 결합은 불가능하다. 따라서 Fe2+, Cu2+ 같은 산소와 높은 결합성을 가진 금속이온이 수행한다. 하지만, 유리상태의 이런 금속이온은 ROS의 생성을 높인다. 따라서 이들은 생체 내에서 활성을 줄인 상태로 이용 가능하다.
heme(헴)은 다음과 같은 특징을 갖는다.
1) 복잡한 유기고리 구조이며 Fe2+ 1개 원자의 배위 결합
2) 4개의 결합이 포르피린 고리 질소 원자에 결합 → "열린" 배위 결합 상태(2개)
3) 4개의 결합 중 1개는 His 잔기의 곁사슬 질소와 결합
4) 4개의 결합 중 또 다른 1개는 산소 분자와 결합

4. 리간드의 상호작용 예 - Myoglobin(마이오글로빈)
분자량 16700, 153개의 아미노산이 존재, Mb(마이오글로빈)의 His93이 heme과 배위 결합을 한다.
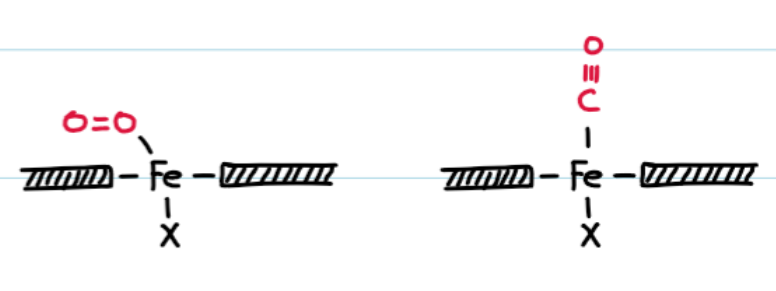
예> CO의 Mb와 heme의 결합 관계
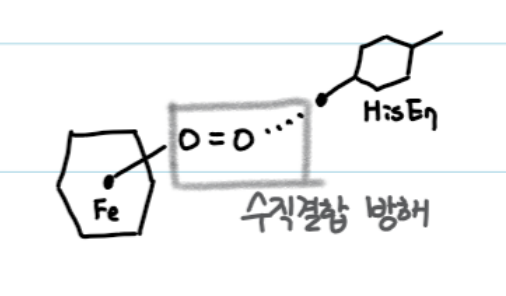
CO가 free heme(유리된 헴)에 결합하는 힘은 O2 보다 2000배 높고, CO가 Mb에 결합하는 힘은 O2보다 200배 높다.
→ 이런 차이는 CO와 O2가 heme에 결합하는 방식이 다르고, Mb의 His E7에 의한 Mb 내의 상호작용은 입체 장애를 형성하여 CO의 heme의 수직 결합을 방해하여 결합력을 떨어트리는 것에서 기인한다.
'생물학 임용노트 > 단백질' 카테고리의 다른 글
| [생물 임용 노트] 효소 - 1) 효소의 개요 (0) | 2023.01.02 |
|---|---|
| [생물 임용 노트] 단백질 - 3) 단백질의 기능: 단백질과 리간드의 협동적 상호 작용 (1) | 2022.12.30 |
| [생물 임용 노트] 단백질 - 2) 단백질의 구조: 단백질의 분해 (0) | 2022.12.28 |
| [생물 임용 노트] 단백질 - 2) 단백질의 구조: 단백질의 접힘 (0) | 2022.12.27 |
| [생물 임용 노트] 단백질 - 2) 단백질의 구조: 단백질의 변성 (1) | 2022.12.26 |



